CRISTINA G. LUCIO- El Mundo- 17/03/2017
Brasil acaba de retirar el producto del mercado.
240 españolas denuncian secuelas tras un implante anticonceptivo.
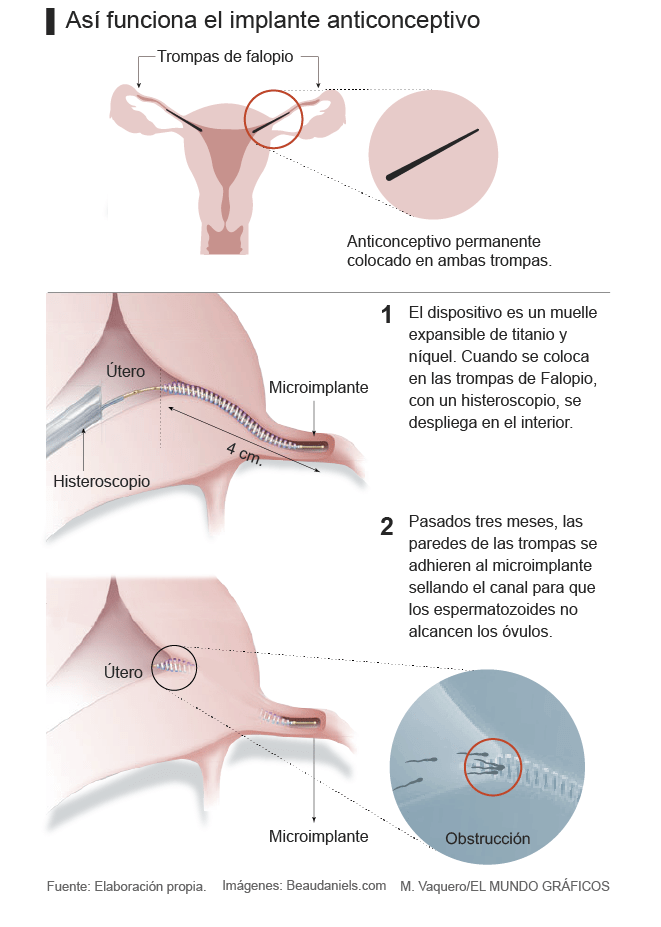
La Audiencia Nacional ha admitido a trámite por primera vez en España una demanda relacionada con el anticonceptivo Essure , un implante que acaba de ser retirado del mercado en Brasil y cuya seguridad se ha puesto en entredicho en todo el mundo. En concreto, el tribunal ha aceptado a trámite la demanda que una de las afectadas, Carolina Díez, ha interpuesto contra el Ministerio de Sanidad, Servicios Sociales e Igualdad y sus órganos dependientes, el Sistema Nacional de Salud y la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) “por error en la vigilancia y control sanitario del producto, así como en la evaluación de las notificaciones de incidentes recibidas y elaboración de alertas informativas y sanitarias”, explica su abogado, Francisco Almodóvar. Almodóvar subraya que esta admisión a trámite supone que “por fin se va a investigar judicialmente la labor de los organismos administrativos que se ocupan de vigilar los productos sanitarios y de proteger la salud de la mujer con respecto a Essure, algo que hasta ahora no se había producido”. El letrado advierte de que las acciones legales no terminarán con esta demanda sino que se ampliarán a “todos los agentes que tienen responsabilidad en este asunto”.Essure es un dispositivo similar a un muelle que se implanta en las trompas de Falopio para, a través de una inflamación y posterior cicatrización en el tejido adyacente, bloquear el acceso de los espermatozoides. La colocación del anticonceptivo no necesita una intervención quirúrgica, por lo que, desde que se aprobó en 2002, se consideraba una alternativa de esterilización femenina más sencilla que la ligadura de trompas. Sin embargo, miles de mujeres en todo el mundo han denunciado las secuelas que se derivan de su implantación. Las quejas más frecuentes tienen que ver con un fuerte dolor en la zona pélvica y abdominal, pero también se han registrado numerosos casos de alergia (por alguno de sus componentes), así como la perforación de las trompas de Falopio, entre otras notificaciones. Un estudio publicado en la revista ‘British Medical Journal’ en 2015 señaló que Essure tiene hasta 10 veces más riesgo de reoperación por problemas en la colocación del dispositivo que la ligadura de trompas. Carolina Diez asegura que vivió “un auténtico martirio” desde que, en 2012, le colocaron el dispositivo. Madre de tres hijos, no quería seguir aumentando la familia, por lo que aceptó sin dudarlo cuando le hablaron de un implante “con el que no era necesario pasar por el quirófano y todo parecían ventajas”. Pero enseguida llegaron los dolores -“terribles, para los que el traumatólogo no encontraba explicación”-, las hemorragias, la inflamación en la zona abdominal y los problemas digestivos.

“Ni el consentimiento informado ni el doctor que me lo implantó en ningún momento me advirtieron de que podría sufrir estas secuelas. Es más, en los documentos figura que el producto está hecho de titanio y luego descubrimos que en sus componentes también estaba el níquel, un material al que luego se demostró que soy alérgica”, señala Diez, que llevó el dispositivo implantado durante tres años. Tampoco nadie le advirtió de que la retirada del dispositivo podría acarrear la pérdida del útero y las trompas de Falopio, como finalmente ocurrió. “Nunca imaginé que eso podría pasar, pero no dudé cuando conseguí que atendieran mis peticiones para quitarlo, porque era insufrible”. De hecho, desde la operación en la que retiraron el dispositivo, las hemorragias y los dolores han desaparecido por completo. “El traumatólogo, que me había indicado hasta cuatro infiltraciones por el dolor tan fuerte que tenía y no conseguía calmar con nada, puso en el informe de alta que los síntomas habían desaparecido tras la retirada del Essure”, señala Carolina, que decidió iniciar acciones legales al vivir “una cadena de irregularidades” y comprobar que otras mujeres “han pasado por el mismo calvario” sin que las administraciones hayan tomado cartas en el asunto y sin que haya un protocolo claro de actuación . “La admisión a trámite de la demanda supone que se van a iniciar investigaciones, es un reconocimiento de que ha habido una serie de fallos que han provocado que Carolina perdiese su útero”, señala Angélica del Valle, presidenta de la Asociación de Afectadas por el Essure, que hoy en día agrupa a 85 mujeres, aunque asegura tener notificación de cientos de casos. La Asociación, que el año pasado mantuvo una serie de encuentros con la AEMPS y la Sociedad Española de Ginecología y Obstetricia (SEGO), consiguió el compromiso de ambos organismos para la elaboración de un nuevo documento de consentimiento informado “que se asegurara de que las pacientes reciban todos los datos importantes antes de decidir si implantarse o no el dispositivo” y para la creación de un protocolo específico de retirada. Sin embargo, las afectadas no están satisfechas con los resultados. “A día de hoy, no hay un método que asegure la retirada del dispositivo con los menores daños y sin que queden fragmentos en el organismo”, señala Del Valle, quien subraya que la información tampoco está llegando correctamente a las posibles usuarias. La mejora de la información que llega al paciente fue, precisamente, una de las medidas que tomó la Agencia estadounidense del medicamento (FDA por sus siglas en inglés) tras llevar a cabo una investigación sobre el producto. En concreto, la institución recomendó a los profesionales sanitarios en EEUU usar una lista de consideraciones para asegurarse de que las pacientes “tienen toda la información necesaria y “comprenden los beneficios y riesgos asociados al dispositivo” antes de tomar una decisión sobre su implante. Aparte de esto, la FDA también decidió llevar a cabo un endurecimiento del etiquetado del producto que hace necesaria la especificación de que, en algunas mujeres, la implantación del dispositivo puede provocar complicaciones graves (Canadá tomo una decisión similar). Previamente, también pidió a la compañía farmacéutica Bayer, fabricante del producto, que llevara a cabo un nuevo estudio sobre la seguridad del dispositivo cuya finalización se espera para 2023. Brasil dio un paso más con respecto a Essure y a principios de este año decidió suspender la comercialización del método anticonceptivo. La Agencia Nacional de Vigilancia Sanitaria del país señaló que se daban evidencias técnico-científicas para motivar la retirada del producto del mercado. Fuentes de Bayer no han querido hacer ningún comentario sobre las acciones legales emprendidas y únicamente han señalado que no han recibido “ninguna información adicional sobre este tema por parte de la AEMPS” y que, con respecto al estudio postcomercialización, “sigue el marcha el procedimiento para su puesta en marcha según lo planificado”. En un comunicado, la farmacéutica ha señalado que “la seguridad del paciente y el uso adecuado de Essure” es su “mayor prioridad”. “La decisión de cada mujer a la hora de elegir un método anticonceptivo es algo muy importante y personal, y Bayer está comprometido a proporcionar a los profesionales médicos los recursos, herramientas y la información necesaria para ayudarles en el consejo anticonceptivo en relación con Essure”. Este medio ha intentado ponerse en contacto con responsables de la Agencia Española del Medicamento, pero no ha obtenido respuesta a sus peticiones.